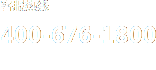|
序号
物资名称
单位
数量
参数
备注
1
一次性医用口罩
副
150000
*1.符合YY0469-2011国家标准
*2.需提供有效期内的注册证
*3.需提供注册检验报告
*4.无菌型
2
医用胶手套
双
50000
*1.符合一次性医用手套GB-10213-2006或行业标准。
*2.无菌型
*3.无粉型
*4.需要提供有效期内的医疗器械产品注册证
3
小型喷壶
台
500
容量:2000ml
4
手推式电动消毒车
台
10
电动消毒车,容量:160L
5
新冠病毒核酸检测试剂
个
20000
1.用途:用于体外定性检测新型冠状病毒感染的肺炎疑似病例、疑似聚集性病例患者、其他需要进行新型冠状病毒感染诊断或鉴别诊断者的口咽拭子、鼻咽拭子和痰液样本中,新型冠状病毒(2019-nCoV)ORF1ab和N基因。
2.包装规格:≤50人份/盒。
3.方法:荧光PCR法。
*4.检测靶标:新型冠状病毒(2019-nCoV)ORF1ab和N基因(诊疗方案推荐ORF1ab、N)
*5.样本类型全面:包括人口咽拭子、鼻咽拭子和痰液,提供国家药监局批准的试剂说明书佐证。(诊疗方案筛查推荐普筛样本类型为鼻拭子)。
*6.试剂盒必须带人的内源性内标,可以监测样本采集、核酸提取及PCR扩增过程,避免假阴性结果的出现。
*7.试剂盒须具有阴性质控品和阳性质控品并参与提取,用于对环境进行监控和PCR检测试剂的质控。
9.适用机型:适用于ABI7500、ABIQ5/Q7,Roche480,伯乐CFX-96,宏石、天隆、雅睿、凯杰等荧光定量PCR仪器。
10.保存条件及效期:避光-20±5℃储存;有效期≥6个月。
*11.最低检测限:≤1000copies/mL。
12.特异性好,与感染部位相同或感染症状相似的其他病原体无交叉反应。
*13.重复性好,CV≤5%。提供2020年新冠核酸检测试剂全国室间质评数据。
*14.加样量≤5ul,样本用量少,易做复孔。
15.反应体系:≤25ul。
*16.扩增时间:≤80分钟。国家药监局注册批准的试剂说明书佐证。
*17.试剂盒具有国家药监局医疗器械注册证;为确保质量,生产厂家需获得ISO9001和ISO13485认证.
6
新冠病毒核酸提取试剂(机提液)
个
20000
1、适用设备:
★1.1通过旋转磁棒、磁吸、转移等动作使磁性颗粒与液体分离,通过裂解、洗涤、洗脱、弃磁珠等步骤后得到高纯度的核酸提取产物;并非旋转样本提取仓实施提取过程。
★1.2、通过震荡磁棒、磁吸、转移等动作使磁性颗粒与液体分离,通过裂解、洗涤、洗脱、弃磁珠等步骤后得到高纯度的核酸提取产物;并非旋转样本提取仓实施提取过程。
2、样本适用性:血清、全血、尿液、粪便、拭子洗液、组织等;
★3、包装形式:试剂组分已经预封装在提取耗材的不同孔位内,高温热封贴膜后抽真空包装;
4、配备单排八孔可拆分搅拌套,可独立拆分为八支独立搅拌套:或震荡联管式搅拌套。
★5、操作简便性:使用时只需加样本,无需再添加其他试剂组分如蛋白酶k等;
★6、多规格可选: ①64T/盒(预封装);16T/板*4板;
②40T/盒(预封装);10T/板×4板
④20T/盒(DT6);1T/条×20条
7、单次提取时间:≤40分钟,其中64T/盒(预封装),16T/板*4板规格的试剂提取时间≤20分钟并提供说明书;
8、储存及有效期:室温保存条件下,有限期为12个月;
9、生产企业具备医疗器械生产及经营许可,具备质量管理体系ISO9001和ISO13485
7
病毒采样管
人份
20000
1.外观:拭子头植绒均匀,白色绒毛;拭子杆无毛刺,边缘圆润;
2.拭子长度:≥14.5cm;拭子头长度:2.0-2.5cm之间
3.吸水性:100ul±20ul
4.毒性试验:不得有抑菌环出现
5.无菌实验:阴性外观
6.断点距离:距离拭子头顶端8cm
|